Introducción
El dolor neuropático, según la Asociación Internacional para el Estudio del Dolor, se define como el dolor que resulta de una lesión o una disfunción del sistema nervioso central o periférico [1]. El dolor neuropático tiene siempre una distribución o una topografía que corresponde a un territorio anatómicamente
definido por una vía nerviosa central o periférica. Se trata del octavo diagnóstico más frecuente en las consultas de neurología [2] y la prevalencia en consultas es del 3,88% [3]. El tratamiento del dolor neuropático resulta complejo y habitualmente los pacientes responden mal a los analgésicos habituales.
Los fármacos antiepilépticos (FAE) son los más utilizados para el tratamiento de estos pacientes, siendo utilizados por el 70,9% de los neurólogos [3]. La carbamacepina se considera clásicamente el tratamiento de elección para la neuralgia del trigémino y otros FAE como la gabapentina [4] o la pregabalina [5] también han podido demostrar su eficacia. Disponemos de otros FAE que también se usan para el dolor neuropático, aunque no se dispone de una base científica amplia que corrobore su eficacia, como es la oxcarbacepina [6], lamotrigina [7], fenitoína, ácido valproico [8], topiramato [9], zonisamida[10] y levetiracetam [11,12]. La mayoría de los FAE se administra por vía oral y necesita una pauta de escalado hasta alcanzar los niveles terapéuticos adecuados. En ocasiones, el dolor neuropático es de instauración rápida y, por tanto, sería beneficioso contar con fármacos de acción inmediata y sin necesidad de un tiempo de espera hasta conseguir la respuesta deseada.
La lacosamida es un nuevo FAE obtenido a partir de un aminoácido funcionalizado con actividad antiepiléptica, disponible en formulación oral e intravenosa. Tiene un mecanismo de acción novedoso, diferente al de otros FAE, que favorece, de forma selectiva, la inactivación lenta de los canales de sodio dependientes del voltaje, sin actuar sobre la inactivación rápida, pudiendo normalizar los umbrales de descarga neuronales. Los FAE clásicos, como la carbamacepina, fenitoína y lamotrigina, actúan potenciando la inactivación rápida de los canales de sodio dependientes de voltaje. La lacosamida presenta una farmacocinética lineal, con elevada biodisponibilidad oral. Tiene un bajo potencial de interacciones con otros fármacos y la baja unión a proteínas minimiza el potencial de desplazamiento de otros medicamentos [13].
![[ES][GR] Figura 1 [ES][GR] Figura 1](http://www.imedhospitales.com/uploads/imagenes/noticias/principal-imagenes/201202/principal-imagenes-figura-1-es_grande.jpg) En la bibliografía podemos encontrar artículos en donde la lacosamida es eficaz en el dolor neuropático [14,15]. Describimos a continuación tres casos de pacientes con dolor neuropático en donde se precisó el uso de tratamiento con lacosamida intravenosa por la necesidad de un control rápido del dolor o por incapacidad del uso de la vía oral.
En la bibliografía podemos encontrar artículos en donde la lacosamida es eficaz en el dolor neuropático [14,15]. Describimos a continuación tres casos de pacientes con dolor neuropático en donde se precisó el uso de tratamiento con lacosamida intravenosa por la necesidad de un control rápido del dolor o por incapacidad del uso de la vía oral.
Casos clínicos
Caso 1
Mujer de 63 años que acude a urgencias por cefalea frontal derecha de 24 horas de evolución y que no responde a antiinflamatorios no esteroideos orales. La exploración neurológica muestra una zona hiperestésica correspondiente a la primera rama del trigémino derecho. La exploración sistémica es normal. Se realiza una tomografía axial computarizada craneal que no muestra hallazgos significativos.
La analítica también es normal. El dolor lo explica como constante, pero con exacerbaciones y sensación de corriente eléctrica. El dolor podría corresponder a una neuralgia de la primera rama del trigémino derecho y se instaura tratamiento con pregabalina, con una dosis inicial de 75 mg el primer día y 150 mg a partir del tercer día, y se mantienen los antiinflamatorios no esteroideos.
A las 48 horas la paciente vuelve a urgencias con un dolor mucho más intenso, lancinante e invalidante. Persiste su localización en la primera rama del trigémino derecho, pero en la exploración llama la atención la aparición de un rash eritematoso con la presencia de vesículas incipientes en la zona dolorosa.
La exploración oftalmológica no muestra lesiones corneales. Además, la nueva analítica muestra un aumento de las transaminasas. Con el diagnóstico de herpes zóster de la primera rama del trigémino en fase aguda y que, además, está provocando un dolor muy invalidante y que no responde al tratamiento oral, se decide su ingreso para tratamiento antiviral y sintomático por vía endovenosa.
La paciente no ha presentado mejoría con la pregabalina con una dosis de 150 mg/día. La gabapentina y la carbamacepina pueden ser opciones válidas, pero también se precisa un período de escalado y, además, la carbamacepina tiene un metabolismo hepático que podría empeorar la hipertransaminasemia.
Por todo ello, se decide iniciar tratamiento con lacosamida intravenosa por su rapidez de acción, nula interacción con los antivirales y un metabolismo renal. La dosis inicial es de 100 mg/12 h. Además, se comienza tratamiento con aciclovir intravenoso.
La paciente presenta una respuesta muy favorable y rápida, con desaparición del dolor en menos de 24 horas tras el inicio de la lacosamida. Además, también presenta una muy buena tolerancia y ningún tipo de efecto secundario. Pasadas las 48 horas, se cambia la vía de administración a oral con una dosis de mantenimiento de 100 mg/12 h. También la erupción presenta una evolución favorable al tratamiento antiviral, con mejoría progresiva de las vesículas y, además, sin afectación ocular. La analítica a las 48 horas muestra un descenso de las transaminasas.
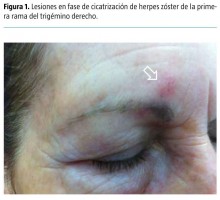
Ante la buena evolución de la paciente, se procede al alta y control en consultas externas pasados unos días. En la revisión ambulatoria, la paciente ha presentado una buena evolución de las lesiones (Fig. 1), se mantiene asintomática y la analítica muestra una resolución de la hipertransaminasemia.
No ha presentado efectos secundarios a la lacosamida, y se decide mantener el tratamiento y plantear la retirada del fármaco de forma progresiva según evolución.
Caso 2
Mujer de 63 años que acude a urgencias por cefalea holocraneal opresiva de unas tres semanas de evolución, junto con malestar general y náuseas. Se realiza una tomografía axial computarizada craneal en urgencias que muestra una lesión en la región de los ganglios de la base derechos con gran edema y efecto masa sobre la línea media. Ante el diagnóstico inicial de lesión ocupante de espacio de probable etiología tumoral, se inicia tratamiento con cortisona en dosis altas, analgesia y tratamiento antiemético.
La paciente presenta una mejoría sintomática durante las primeras 24 horas, pero, de forma brusca, aparece un dolor muy intenso, desagradable y urente en el hemicuerpo izquierdo, con nula respuesta al aumento de la analgesia, incluyendo el uso de opioides.
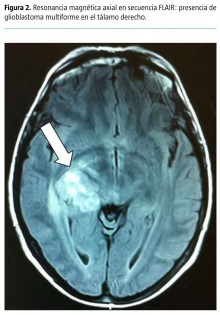
La resonancia magnética craneal muestra la presencia de una lesión tumoral heterogénea talámica derecha. Los márgenes están desdibujados, con captación irregular de contraste, y presenta focos necróticos. Asocia un edema vasogénico digitiforme con borramiento de los surcos cerebrales y, medialmente, induce compresión del ventrículo lateral con desviación de la línea media (Fig. 2). Se sospecha un dolor neuropático de origen talámico (síndrome de Déjerine-Roussy); ante la gravedad e intensidad de los síntomas, se decide iniciar tratamiento con lacosamida intravenosa por la rapidez de acción. La paciente presenta una respuesta muy favorable y queda asintomática a las pocas horas de realizar una carga inicial con 100 mg de lacosamida.
No presenta ninguna clase de efectos secundarios. Se mantiene un tratamiento de continuación con lacosamida 100 mg/12 h de forma intravenosa, pues la paciente está pendiente de realizarse una biopsia cerebral. El resultado de la biopsia muestra la presencia de un glioblastoma multiforme y es inaccesible quirúrgicamente, por lo que se inicia tratamiento paliativo con quimioterapia y radioterapia.
Tras tres meses desde el diagnóstico del tumor, la paciente se mantiene sin dolor y con buena tolerancia al tratamiento oncológico. La dosis de lacosamida se mantiene en 100 mg/12 h por vía oral.
Caso 3
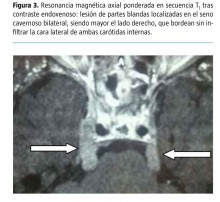
Varón de 40 años diagnosticado en octubre de 2007 de leucemia linfoide crónica. Recibió tratamiento quimioterápico, alcanzando remisión completa. Presenta una recaída en marzo de 2011 con el diagnóstico de síndrome de Richter (transformación a linfoma difuso de célula grande B) con masa extrapleural que destruye la costilla e infiltración de la médula ósea. Tras un ciclo de quimioterapia tipo CHOP, presenta cefalea y disfagia progresiva, por lo que se realiza resonancia magnética craneal que muestra una infiltración del parénquima cerebral extensa y afectación de los pares craneales (Fig. 3). En la punción lumbar aparece una infiltración linfoidea. A pesar de los ciclos de quimioterapia, la clínica neurológica continúa progresando, apareciendo paresia del III y VI par derecho, dolor de características neuropáticas en la hemicara derecha, y debilidad y parestesias en las extremidades inferiores por infiltración de cola de caballo.
![[ES][GR] Figura 2 [ES][GR] Figura 2](http://www.imedhospitales.com/uploads/imagenes/noticias/principal-imagenes/201202/principal-imagenes-figura-2-es_grande.jpg) Ante la presencia de un dolor intenso y resistente a la morfina e intolerancia oral, se inicia tratamiento con lacosamida intravenosa con una dosis inicial de 100 mg/12 h, con rápida mejora del dolor.
Ante la presencia de un dolor intenso y resistente a la morfina e intolerancia oral, se inicia tratamiento con lacosamida intravenosa con una dosis inicial de 100 mg/12 h, con rápida mejora del dolor.
El paciente presenta una mejoría de la sintomatología neurológica tras continuar con el tratamiento con quimioterapia sistémica y también intratecal, y se cambia la lacosamida a vía oral con una dosis de mantenimiento de 100 mg/12 h. Pasadas varias semanas, el paciente presenta una nueva recaída con afectación progresiva del estado de consciencia hasta que finalmente el paciente fallece. Durante los dos meses con tratamiento con lacosamida, el paciente no volvió a presentar dolor neuropático y no presentó efectos secundarios atribuibles a ella.
Discusión
En la actualidad no disponemos de esquemas de tratamiento del dolor neuropático con una evidencia científica demostrada y, por tanto, debe ser un tratamiento individualizado basándose en la eficacia y el perfil de efectos secundarios de los fármacos.
En nuestros casos, el uso de la lacosamida se ha mostrado muy útil para el control de dolor, con una gran rapidez de acción, una excelente tolerabilidad y nula interacción con otros fármacos.
Los mecanismos para el efecto antinociceptivo de la lacosamida y sus diferencias de género no son claros. Además de la inactivación lenta de los canales de sodio dependientes del voltaje, los estudios in vitro han demostrado que la lacosamida reduce las corrientes evocadas por el glutamato en las neuronas corticales del ratón y aumenta las corrientes dependientes del ácido γ aminobutírico. Ambos mecanismos pueden ser importantes para el efecto analgésico de la lacosamida. El mecanismo de acción de este compuesto continúa sin estar totalmente establecido, ya que no se une a un gran número de receptores o enzimas [13].
![[ES][GR] Figura 3 [ES][GR] Figura 3](http://www.imedhospitales.com/uploads/imagenes/noticias/principal-imagenes/201202/principal-imagenes-figura-3-es_grande.jpg) La lacosamida ha demostrado su eficacia en una serie de modelos de dolor neuropático: la neuropatía inducida por la vincristina, la ligadura del nervio espinal, el modelo yodoacetatomonosódico del dolor artrósico, la ligadura del nervio espinal, el dolor óseo oncológico por tumor inducido, el dolor de lesión de la médula espinal, la lesión del nervio infraorbitario de la neuralgia del trigémino y el modelo estreptozotocina de la neuropatía diabética dolorosa [14,15].
La lacosamida ha demostrado su eficacia en una serie de modelos de dolor neuropático: la neuropatía inducida por la vincristina, la ligadura del nervio espinal, el modelo yodoacetatomonosódico del dolor artrósico, la ligadura del nervio espinal, el dolor óseo oncológico por tumor inducido, el dolor de lesión de la médula espinal, la lesión del nervio infraorbitario de la neuralgia del trigémino y el modelo estreptozotocina de la neuropatía diabética dolorosa [14,15].
La lacosamida presenta una farmacocinética lineal con elevada biodisponibilidad oral y eliminación renal [16]. Tiene un bajo potencial de interacciones con otros fármacos, y su baja unión a proteínas (< 15%) reduce el potencial de desplazamiento de otros fármacos [17]. Presenta una baja o nula interacción con el CYP450, lo que minimiza el efecto sobre otros fármacos [18]. Los estudios han demostrado que la lacosamida no altera los niveles plasmáticos de otros FAE, así como de otros fármacos como digoxina, omeprazol y anticonceptivos orales, entre otros [13].
La lacosamida se tolera generalmente bien y la mayoría de efectos secundarios se pueden considerar leves o moderados, siendo los más comunes el mareo, cefalea, náuseas o diplopía. Aunque no prolonga el intervalo QT ni tiene efecto sobre el segmento QRS, se ha observado un pequeño incremento en la media del intervalo PR, pero sin comunicarse efectos adversos en relación con dicho aumento y siendo éste similar al inducido por otros fármacos como carbamacepina, lamotrigina y pregabalina.
El perfil de tolerabilidad de la lacosamida intravenosa es similar a la formulación oral y el dolor en el punto de infusión es infrecuente [13]. En nuestros tres casos descritos, la necesidad de encontrar un tratamiento con eficacia demostrada, rapidez de acción, con un buen perfil de tolerancia y baja interacciones con otros fármacos nos hizo iniciar tratamiento con lacosamida intravenosa.
La incidencia de herpes zóster varía entre 1,3-4,8 por 1.000 personas, y la población comprendida entre los 50-70 años acumula más del 40% de los casos [19]. La afectación del trigémino es la forma más dolorosa de neuralgia herpética [20]. La incidencia de una neuralgia postherpética varía entre el 9-14% de los casos de herpes zóster [21,22], y los FAE han demostrado ser eficaces para el control álgico de los pacientes [23]. En nuestro caso, la lacosamida intravenosa provocó una mejoría muy llamativa a las pocas horas del inicio del tratamiento, por lo que su uso podría ser beneficioso en el control del dolor del herpes zóster en fase aguda. También quedaría por definir su papel en la neuralgia postherpética.
El síndrome talámico de Déjerine-Roussy se describió en 1903 [24,25] y hace mención a la presencia de un dolor muy intenso, constante, con sensación urente, lacerante y asociado habitualmente a hiperestesia dolorosa en la misma distribución. El dolor es refractario a los analgésicos comunes. Los FAE han demostrado ser eficaces en el control del dolor en el síndrome talámico [26,27], y nosotros hemos obtenido una respuesta altamente satisfactoria e inmediata tras la carga inicial de lacosamida, siendo, además, un fármaco que nos permite su uso de forma intravenosa en pacientes que deben ser intervenidos en breve período y que, por tanto, no podrán utilizar la vía oral por un cierto tiempo.
También es importante remarcar la nula interacción con otros fármacos, al tratarse de un paciente oncológico que precisará el uso de quimioterapia y probablemente el uso de antibióticos en caso de complicaciones. La eficacia del tratamiento se ha mantenido en el tiempo.
El linfoma secundario se define como la afectación del sistema nervioso central, no evidenciada al inicio del tratamiento del linfoma sistémico. La supervivencia mediana es de 4-5 meses y sólo un 25% vive más de un año [28]. En cuanto al tratamiento, los resultados que hay comunicados en todas las series son malos [29]. Los datos clínicos más frecuentes son cefalea, parálisis de pares craneales, compresión medular y alteración del estado mental. En nuestro caso, la presencia de dolor facial muy intenso correspondería a la infiltración del nervio trigémino y la respuesta a la lacosamida ha sido muy favorable, y el paciente quedó sin dolor a las pocas horas de inicio del tratamiento. Además, la vía intravenosa ha sido muy útil en un paciente con una disfagia grave y, una vez más, hay que remarcar la buena tolerancia y la ausencia de interacciones en un paciente polimedicado.
En conclusión, la lacosamida pertenece a una nueva generación de FAE, con una farmacocinética favorable y un novedoso mecanismo de acción. Consideramos, a luz de nuestra experiencia y de la bibliografía publicada [14,15], que la lacosamida puede ser una alternativa útil para el control del dolor neuropático, más aún cuando la vía intravenosa nos permite una gran rapidez de acción y una buena tolerabilidad. Además, su perfil de seguridad y nula interacción con otros fármacos puede ser válido en pacientes con múltiples patologías y tratamientos. En nuestros casos, la dosis de 200 mg/día se ha mostrado eficaz. Serán necesarios estudios más extensos y aleatorizados para confirmar estos datos.
Bibliografía
1. International Association for the Study of Pain. Subcommittee on Taxonomy. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. Pain 1986; 3: S1-226.
2. Carneado-Ruiz J, Morera-Guitart J, Alfaro-Sáez A, Turpín-Fenoll L, Serna-Candel C, Matías-Guiu Guía J. El dolor neuropático como motivo de consulta en neurología: análisis de su frecuencia. Rev Neurol 2005; 41: 643-8.
3. Montero J, Gutiérrez E, Pardo J, Navarro C. Estudio de prevalencia, incidencia y caracterización del dolor neuropático en consultas de neurología. Estudio Prevadol. Neurologia
2005; 20: 385-9.
4. Wiffen PJ, McQuay HJ, Eduards JE, Moore RA. Gabapentin for acute and chronic pain. Cochrane Database Syst Rev 2005; 3: CD005452.
5. Freynhagen R, Strojek K, Griesing T, Whalen E, Balkenohl M. Efficacy of pregabaline in neurophatic evaluated in a 12-week, randomized, double-blind, placebo-controlled trial of flexible-and fixed-dose regimens. Pain 2005; 6: 253-60.
6. Carrazana E, Mikoshiva I. Rationale and evidence for the use of oxcarbazepine in neurophatic pain. J Pain Symptom Manage 2003; 25 (Suppl 5): S31.
7. Wiffen PJ, Rees J. Lamotrigine for acute and chronic pain. Cochrane Database Syst Rev 2007; 2: CD006044.
8. Rivera MV, Mesas A, Mora L. Tratamiento farmacológico del dolor neuropático. In Catafau S, ed. Tratado de dolor neuropático. Buenos Aires: Médica Panamericana; 2006. p. 287-98.
9. Raskin P, Donofrio PD, Rosenthal NR, Hewitt DJ, Jordan DM, Xiang J, et al. Topiramate vs placebo in painful diabetic neuropathy: analgesic and metabolic effects. Neurology
2004; 63: 865-73.
10. Atli A, Dogra S. Zonisamide in the treatment of painful diabetic neuropathy: a randomized, double-blind, placebo-controlled pilot study. Pain Med 2005; 6: 224-34.
11. Ozcan M, Ayar A, Canpolat S, Kutlu S. Antinociceptive efficacy of levetiracetam in a mice model for painful diabetic neuropath. Acta Anaesthesiol Scand 2008; 52: 926-30.
12. Del Pozo E, Pereira-Pérez E, González-Contreras LG. Eficacia del levetiracetam en el tratamiento del dolor neuropático. Rev Neurol 2011; 53: 65-72.
13. Gil-Nagel A, Martin H. Lacosamida: una nueva generación en el tratamiento de la epilepsia. Rev Neurol 2011; 52: 159-62.
14. Wymer JP, Simpson J, Sen D, Bongardt S. Efficacy and safety of lacosamide in diabetic neuropathic pain. An 18-week double-blind placebo-controlled trial of fixed-doses regiments. Clin J Pain 2009; 25: 376-85.
15. Shaibani A, Fares S, Selam JL, Arslanian A, Simpson J, Sen D, et al. Lacosamide in painful diabetic neuropathy: an 18-week double-blind placebo-controlled trial. J Pain 2009; 10: 818-28.
16. Horstmann R, Bonn R, Cawello W. Basic clinical pharmacological investigation of the new antiepileptic drug SPM-927. Epilepsia 2002; 43: 188.
17. Bialer M, Johannessen SI, Kupferberg HJ, Levy RH, Perucca E, Tomson T. Progress report on the new antiepileptic drugs: a summary of the Eight Eilat Conference (Eilat VIII). Epilepsy Res 2007; 73: 1-52.
18. UCB. Vimpat. Summary of product characteristics. Brussels: UCB Pharma; 2008.
19. Donahue JG, Choo PW, Manson JE, Platt R. The incidence of herpes zoster. Arch Intern Med 1995; 155: 1605-9.
20. Dworkin RH, Portenoy RK. Proposed classification of herpes zoster pain. Lancet 1994; 343: 1648.
21. Alpers BS, Lewis PR. Does treatment of acute herpes zoster prevent or shorten postherpetic neuralgia? A systematic review of the literature. J Fam Pract 2000; 49: 225-64.
22. Jung BF, Johnson RW, Griffin DR. Risk factors for postherpetic neuralgia in patients with herpes zoster. Neurology 2004;62: 1545-51.
23. Dubinsky RM, Kabbani H, El-Chami Z, Boutwell C, Ali H. Practice parameter: treatment of postherpetic neuralgia: an evidence-based report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2004; 63: 959-65.
24. Déjerine J, Roussy G. Le syndrome thalamique. Rev Neurol (Paris) 1906; 14: 521-32.
25. Lhermite J, Fumet. Syndrome thalamique. Rev Neurol (Paris) 1921; 37: 1259-62.
26. Bonica JJ. Introduction. In Nashold BS, Ovelment-Levitt J, eds. Advances in pain research and therapy. New York: Raven Press; 1995. p. 1-19.
27. Salazar-Zúñiga A, Carrasco-Vargas H. Tratamiento del síndrome talámico (Déjerine-Roussy) secundario a infarto cerebral isquémico, con gabapentina. Reporte de cuatro casos y revisión de la literatura. Neurol Neurocir Psiquiatr 2006; 39: 70-5.
28. Hollender A, Kvaloy S, Lote K, Nome O, Holte H. Prognostic factors in 140 adult patients with non-Hodgkin’s lymphoma with systemic central nervous system (CNS) involvement. A single centre analysis. Eur J Cancer 2000; 36: 1762-8.
29. Kawamura T, Koga S, Okamoto M, Kanno T, Iwamura H. Results of combined-modality therapy for primary and secondary malignant lymphoma of the central nervous system (CNS). Radiat Med 2001; 19: 145-9.